Cloruro de cromo(III)
Plantilla:Ficha de compuesto químico
El cloruro de cromo(III) (también llamado cloruro crómico) se trata de un compuesto inorgánico de fórmula CrCl3(H2O)x, donde x puede ser 0, 5 y 6. El compuesto anhidro con la fórmula CrCl3 es un sólido violeta bastante higroscópico. La forma más común del cloruoro crómico es el verde oscuro de su forma "hexahidratada", CrCl3.6H2O. Uno de sus usos es como colorante para la lana.
Estructura
El cloruro de cromo(III) anhidro adopta la estructura del YCl3, con los cationes Cr3+ ocupando dos tercios de los huecos octaédricos, en capas alternas, formando un pseudo-empaquetamiento compacto de iones Cl- en la red. La ausencia de cationes en las capas alternas conduce a una débil unión entre las capas adyacentes. Por esta razón, los cristales de CrCl3 escinden fácilmente a lo largo de los planos entre las capas, lo que resulta en la apariencia escamosa (micáceo) de las muestras de cloruro de cromo(III).[1]
-
Modelo de espacio lleno del empaquetamiento cúbico compacto de los iones cloruro de la estructura cristalina del CrCl3
-
Modelo de barras y esferas de parte de una capa
-
Apilamiento de capas
-
Celda unidad del CrCl3
Síntesis
El cloruro de cromo(III) se puede obtener por reacción de cromo con cloro:[2]
Comercialmente, el cloruro de cromo(III) anhidro se puede preparar por cloración de cromo metálico directamente, o indirectamente mediante la cloración de óxido de cromo(III) en presencia de carbono a 650-800 °C, con monóxido de carbono como producto secundario:[3]
También se puede preparar por tratamiento del cloruro de cromo(III) hexahidratado con cloruro de tionilo:[4]
Reactividad y usos
Con cloruros de metales alcalinos fundidos, tales como cloruro de potasio, el CrCl3 da complejos octaédricos del tipo K3CrCl6, así como K3Cr2Cl9, que también es octaédrico, pero donde los dos átomos de cromo están unidos a través de tres puentes cloruro.
El papel de la catálisis del Cr(II) en reacciones de sustitución
Las velocidades de reacción con complejos de cromo(III) normalmente son lentas. La baja reactividad del ion Cr3+ (un ion d3) puede explicarse mediante la teoría del campo cristalino. Una forma de mejorar esto consiste en reducir, incluso en cantidad de trazas, el CrCl3 a CrCl2, por ejemplo usando cinc en ácido clorhídrico. Este compuesto de cromo(II), se somete a sustitución con facilidad, y puede intercambiar electrones con el CrCl3 a través de un puente de cloruro, permitiendo que todo el CrCl3 reaccione rápidamente. Es decir, el CrCl2 actúa como catalizador.
Con la presencia de algo de cromo(II), el CrCl3 sólido se disuelve rápidamente en agua. Del mismo modo, las reacciones de sustitución de ligandos de soluciones de [CrCl2(H2O)4]+ son acelerados por catalizadores de cromo(II).[5]
En disolución, se pueden formar diferentes complejos hidratados isómeros de diferente color. Por ejemplo, el cloruro de diclorotetraacuacromo(III), de color verde oscuro; el cloruro de cloropentaacuacromo(III), verde brillante; o el cloruro de hexaacuacromo(III), violeta. Aquí se describen estos complejos siguiendo los equilibrios:[6]
Complejos con ligandos orgánicos
El cloruro crómico es un ácido de Lewis, clasificado como "duro", de acuerdo a la teoría ácido-base duro-blando. Se puede formar una variedad de aductos del tipo [CrCl3L3]z octaédricos, en donde L es un ligando o base de Lewis. Por ejemplo, la reacción con piridina (C5H5N) para formar un complejo o aducto:
El tratamiento con cloruro de trimetilsililo en THF da el complejo anhidro con THF:
Precursor de complejos de organocromo
El cloruro de cromo(III) se utiliza como precursor de muchos compuestos inorgánicos de cromo, por ejemplo, el bis(benceno)cromo, un análogo del ferroceno:
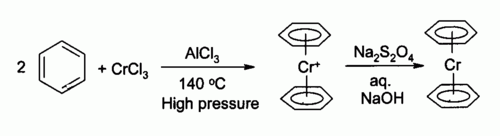
El cromoceno también puede prepararse a partir de cloruro de cromo(III) en un proceso rédox:[7]
Complejos de fosfina derivados del CrCl3 catalizan la trimerización de etileno a 1-hexeno.[8][9]
Usos en química orgánica
Un uso del CrCl3 es en la síntesis orgánica para la preparación in situ de cloruro de cromo(II), un reactivo popular para (A) la reducción de haluros de alquilo, y (B) la síntesis de haluros de (E)-alquenilo. La reacción se lleva a cabo por lo general el uso de dos moles de CrCl3 por mol de hidruro de litio y aluminio, aunque si las condiciones acuosas ácidas son apropiadas, el zinc y el ácido clorhídrico puede ser suficiente:
El cloruro de cromo(III) también se ha utilizado como un ácido de Lewis en las reacciones orgánicas, por ejemplo, para catalizar la reacción de Diels-Alder de reactivos con un grupo nitroso (NO).[10]
Referencias
Plantilla:Control de autoridades
- ↑ Plantilla:Cita libro
- ↑ Plantilla:Cita libro
- ↑ D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- ↑ Pray, A. P. Anhydrous Metal Chlorides Inorganic Syntheses, 1990, vol 28, 321–2. Plantilla:Doi
- ↑ Plantilla:Cita libro
- ↑ Plantilla:Cita libro
- ↑ Plantilla:Cita libro
- ↑ John T. Dixon, Mike J. Green, Fiona M. Hess, David H. Morgan “Advances in selective ethylene trimerisation – a critical overview” Journal of Organometallic Chemistry 2004, Volume 689, Pages 3641-3668. Plantilla:Doi
- ↑ Feng Zheng, Akella Sivaramakrishna, John R. Moss “Thermal studies on metallacycloalkanes” Coordination Chemistry Reviews 2007, Volume 251, 2056-2071. Plantilla:Doi
- ↑ Plantilla:Cita publicación




